ثابت عمومی گاز هیدروژن
ثابت عمومی گاز هیدروژن، که با نماد R نمایش داده میشود، برابر است با 8.314 ژول بر کلوین بر مول J/(mol·K)) یا 0.0821 لیتر آتمسفر بر مول بر کلوین L·atm/(mol·K)). این ثابت، مرتبط با رابطه بین فشار، حجم، دما و تعداد مولهای گاز است.
ثابت عمومی R برای گازهای مختلف برابر است، اما برای هر گاز خاص، مقدارهای مختلفی از فشار و حجم را میتوان با استفاده از این ثابت محاسبه کرد. در مورد این گاز، این ثابت برای محاسبه خصوصیات فیزیکی و ترمودینامیکی آن، از جمله فشار، حجم، دما و انرژیها، استفاده میشود.

بررسی فرمول ثابت عمومی گاز هیدروژن
فرمول ثابت عمومی گاز هیدروژن ، که با نماد R نمایش داده میشود، برابر است با 8.314 ژول بر مول بر کلوین (J/(mol·K)) یا 0.0821 لیتر آتمسفر بر مول بر کلوین (L·atm/(mol·K)).
در این فرمول، مقادیر مختلفی وجود دارد:
– 8.314: این عدد نشاندهنده مقدار ثابت عمومی است.
– ژول بر کلون: ژول واحد انرژی است و برابر است با کاری که توسط یک نیروی یک نیوتن در طول یک متر انجام میشود. کلون نیز واحد بار الکتریکی است. ژول (Joule) واحدی برای اندازهگیری انرژی و کار در سیستم بینالمللی واحدهای (SI) است.
نام این واحد به افتخار فيزیكدان و مهندس انگلیسی جیمز پرسیوال ژول (James Prescott Joule) است که مطالعات و کشفهای مهمی در زمینه انرژی و گرما انجام داد. جول برابر با کاری است که توسط یک نیروی یک نیوتن (N) در طول یک متر (m) انجام میشود.
اصطلاحاً، ژول بیانگر انتقال انرژی است. به عنوان مثال، اگر به یک جسم به اندازه یک نیوتن یک نیرو اعمال کنید و آن را در طول یک متر حرکت دهید، کار انجام شده توسط شما برابر با یک ژول است. همچنین، ژول معادل با یک وات بر ثانیه است، که واحد توان را نشان میدهد.
ژول به عنوان واحدی جهت اندازهگیری انرژی در تمامی زمینههای علمی و فنی مورد استفاده قرار میگیرد، از جمله فیزیک، شیمی، الکترونیک، مهندسی و سایر علوم ذاتاً مرتبط با انرژی و قدرت.
– مول: واحد مقدار ماده است که برابر است با تعداد ذرات یک ماده مشخص. مول واحدی است که در علم شیمی و فیزیک برای اندازهگیری تعداد ذرات یک ماده استفاده میشود.
مول به معنای تعداد ذراتی است که برابر با تعداد ذرات موجود در یک مولکول، یون یا دیگر موجودیتهای شیمیایی میباشد.
به طور دقیقتر، یک مول برابر با تعداد ذراتی است که در آن تعداد ذرات برابر است با عدد آووگادرو، که حدوداً برابر است با 6.022 × 10^23 ذره. این عدد آووگادرو (نماد آن NA) نشاندهنده تعداد ذراتی است که در یک مولکول موجود هستند.
استفاده از مفهوم مول در اندازهگیری تعداد ذرات، امکان مقایسه مواد مختلف را فراهم میکند. با تعیین تعداد مولهای یک ماده، میتوانیم تعداد ذرات و جرم ماده را به دست آوریم و در محاسبات شیمیایی و فیزیکی استفاده کنیم.
– کلوین: واحد دما است که برابر با یک درجه سانتیگراد است، اما در مقیاس مطلق ترمودینامیکی قرار دارد.
با استفاده از این فرمول، میتوانیم در محاسبات ترمودینامیکی و فیزیکی مرتبط با گاز Hydrogen از ثابت عمومی استفاده کنیم.

عوامل موثر در ثابت عمومی گاز هیدروژن
ثابت عمومی گاز هیدروژن (نماد R) به طور کلی تحت تأثیر عوامل زیر قرار میگیرد:
1. جنس گاز: ثابت عمومی گاز هیدروژن مشخص شده است و برای سایر گازها مقادیر متفاوتی دارد. این ثابت به مراتب از جنس و خصوصیات مولکولی گاز تعیین میشود.
2. واحد استفاده شده: مقدار ثابت عمومی گاز هیدروژن میتواند به تعداد واحد استفاده شده تغییر کند. به عنوان مثال، در واحد جول بر کلومل بر مول بر کلووین (J/(mol·K))، مقدار ثابت برابر با 8.314 است. در واحدهای دیگری مانند کیلوژول بر مول بر کلووین (kJ/(mol·K))، مقدار ثابت عمومی برابر با 8.314 × 10^-3 میشود.
3. دقت اندازهگیری: در تجربههای عملی و آزمایشگاهی، دقت اندازهگیری ثابت عمومی گازHydrogen تأثیرگذار است. دقت بالاتر در اندازهگیری پارامترهایی مانند فشار، حجم و دما، به تأثیر مستقیم در دقت محاسبات مبتنی بر ثابت عمومی میباشد.
4. شرایط دما و فشار: ثابت عمومی گاز هیدروژن براساس شرایط دما و فشار مشخص شده است. در شرایط معمول، این ثابت معادل با 8.314 جول بر کلومل بر مول بر کلووین (J/(mol·K)) است. با افزایش یا کاهش شرایط دما و فشار، مقدار ثابت نیز تغییر میکند.
جنس گاز
در واقع، ثابت عمومی برای هر گاز خاص مشخص شده است و برای هر گاز، مقدار متفاوتی دارد. برای مثال، ثابت عمومی گاز هیدروژن معادل 8.314 ژول بر مول بر کلووین (J/(mol·K)) است.
این مقدار بر اساس خصوصیات مولکولی و رفتار گاز هیدروژن در شرایط دما و فشار استاندارد تعیین شده است.
بنابراین، میتوان گفت که جنس گاز تأثیر مستقیمی بر مقدار ثابت عمومی آن دارد. هر گاز با توجه به خصوصیات مولکولی و رفتارش در شرایط معین، مقداری خاص برای ثابت عمومی خواهد داشت.
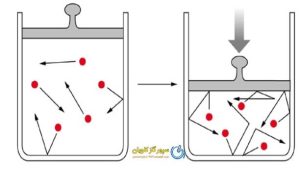
دما و فشار
دما و فشار دو پارامتر مهم هستند که تأثیر مستقیم بر ثابت عمومی دارند. در مورد تأثیر هر کدام از این پارامترها بر ثابت عمومی بیشتر بدانیم:
1. تأثیر دما: تغییر دما میتواند تأثیر قابل توجهی بر ثابت عمومی گاز داشته باشد. برای بسیاری از گازها، ثابت عمومی با افزایش دما افزایش مییابد. به عبارتی دیگر، با افزایش دما، ثابت عمومی افزایش مییابد و با کاهش دما، ثابت عمومی کاهش مییابد.
این رابطه معمولاً در قالب قانون بویل-چارلز قابل توصیف است. برای برخی گازها مانند گاز هیدروژن، رابطه خطی بین ثابت عمومی و دما برقرار است.
2. تأثیر فشار: تغییر فشار نیز میتواند تأثیر قابل توجهی بر ثابت عمومی گاز داشته باشد. در بسیاری از موارد، با افزایش فشار، ثابت عمومی گازها افزایش مییابد و با کاهش فشار، ثابت عمومی کاهش مییابد. این رابطه معمولاً در قالب قانون وان دروالس قابل توصیف است.




