گاز هیدروژن
گاز هیدروژن یک گاز بیرنگ، بیبو و بیذائقه است. بخشی از ترکیبات شیمیایی این گاز شامل یک اتم هیدروژن است. عنصر شیمیایی هیدروژن با نماد H و عدد اتمی ۱ شناخته میشود.
این گاز بسیار سبک است و در شرایط استاندارد به صورت یک گاز دیگر قابلیت تشخیص و شناسایی دارد. به دلیل سبکی خود، Hydrogen به عنوان یک برقگیر خوب استفاده میشود و در صنعت، پژوهش و بسیاری از کاربردهای دیگر بهرهبرداری میشود.
Hydrogen در مادهای بسیار سبک است و به همین دلیل برای بالابردن بارها به کار میرود. از طرف دیگر، در شرایط دما و فشار بسیار بالا، H به صورت فلزی با ویژگیهای فلزی مانند رسانایی الکتریکی و حرارتی عمل میکند.
این گاز از نظر شیمیایی به عنوان یک عنصر بسیار متفاوت و منحصر به فرد در نظر گرفته میشود. به عنوان یک گونه ناپایدار، این گاز بسیار پراکنده در جوانما و جوانخواهان زمین است و به طور طبیعی در ارتباط با عناصر دیگر قرار میگیرد.

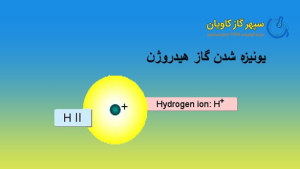
یونیزه شدن
یونیزه شدن این گاز به معنای تغییر گاز هیدروژن (H2) به یونهای هیدروژن مثبت (H+) است. این گاز در شرایط عادی الکترون ندارد و از دو اتم هیدروژن (H) تشکیل شده است. اما در شرایط خاص، میتوان اتمهایاین گاز را به یونهای Hydrogenمثبت تبدیل کرد.
روشهای مختلفی برای یونیزه کردن این گاز وجود دارد. یکی از روشهای معمول برای یونیزه شدن این گاز ، استفاده از تخلیه الکتریکی است. در این روش، این گازدر حضور یک منبع انرژی الکتریکی (مانند قوس الکتریکی یا تخلیه الکتریکی مستقیم) قرار میگیرد. در اثر تأثیر این انرژی الکتریکی، اتمهای این گاز به یونهای هیدروژن مثبت تبدیل میشوند.
پس از یونیزه شدن،Hydrogen دارای یونهای مثبت (H+) میشود. این یونها دارای یک الکترون کمتر نسبت به این گاز غیریونیزه شده هستند. یونهای Hydrogenمثبت بسیار حساس و پرتابل هستند و در آب و دیگر محیطهای متفاوت قابل استفاده هستند.
مزایای یونیزه شدن این گاز شامل قابلیت استفاده در فرآیندهای شیمیایی، تولید برق در سلولهای سوختی این گاز و کاربردهای پزشکی (مانند تصویربرداری پزشکی) است. برای خرید گاز هیدروژن تماس بگیرید، همچنین، یونیزه شدن این گازدر تحقیقات علمی و فناوری نیز به طور گسترده مورد استفاده قرار میگیرد.

تولید گاز هیدروژن
1. الکترولیز آب: الکترولیز آب یکی از روشهای شناخته شده برای تولید این گاز است. در این روش، آب با استفاده از جریان الکتریکی به Hydrogen و اکسیژن تجزیه میشود. دو الکترود مثبت (آند) و منفی (کاتد) درون محلول آب قرار گرفته و هیدروژن به سمت الکترود منفی میرود و اکسیژن به سمت الکترود مثبت میرود.
2. استخراج از سوختهای فسیلی: Hمیتواند از سوختهای فسیلی مانند گاز طبیعی، نفت و ذغال سنگ استخراج شود. یکی از روشهای استخراج این گازاز گاز طبیعی فرایند ریفرمینگ است که در آن گاز طبیعی با بخار آب و کاتالیزورهای خاص بازواکنش میدهد تا H و دیگر ترکیبات شیمیایی تولید شود.
3. تجزیه هیدروکربنها: این گاز میتواند از تجزیه هیدروکربنها، مانند متان، تولید شود. این فرایند معمولاً در واحدهای تولید Hydrogen صنعتی مانند ایستگاههای استخراج و پالایشگاهها انجام میشود.
4. فرایند آبگیری از مواد شیمیایی: در برخی فرایندها، این گاز میتواند از مواد شیمیایی خاصی مانند آمونیاک (فرایند هابر) یا هیدروژن سولفید (فرایند کلر) آزاد شود.
5. بیوگازدهی: Hydrogen میتواند از فرایند بیوگازدهی استخراج شود که در آن مواد آلی توسط میکروارگانیسمها تجزیه میشوند و هیدروژن آزاد میشود.
آیا هیدروژن خطر دارد؟
مانند بسیاری از مواد شیمیایی، این گاز نیز ممکن است خطراتی داشته باشد.
1. قابل اشتعال: Hydrogen قابل اشتعال است و در صورت ترکیدن، امکان ایجاد آتشسوزی و انفجار وجود دارد. در حضور هوا،H به سرعت مخلوط میشود و ممکن است مناطقی با غلظت بالای هیدروژن که اشتعال پذیر هستند، ایجاد شود.
2. پرفشاری: این گازبا فشار بالا است و میتواند در صورت نگهداری و انتقال نادرست فشار بالایی ایجاد کند. این ممکن است به خطراتی مانند انفجار و تخریب تجهیزات منجر شود.
3. تنفس غیرمساعد: در صورت تنفس در محیطی که غلظت H بالا است، هیدروژن ممکن است باعث کاهش میزان اکسیژن در هوا شود که به عوارض ناشی از تنفس غیرمساعد و کاهش اکسیژن در بدن منجر شود.
4. خطر انفجار در انبار و حملونقل: این گاز بسیار قابل انفجار است و در صورت نگهداری و حملونقل نامناسب، خطرات جدی ایجاد میشود. ایجاد فضای مناسب و استفاده از تجهیزات و روشهای ایمنی برای کنترل و کاهش خطر انفجار بسیار مهم است.
5. سمیت: در غلظتهای بالا، هیدروژن ممکن است سمیت داشته باشد و به عوارض صحی مانند سرگیجه، تهوع، اختلال در تنفس و در موارد شدیدتر، خفگی و مسمومیت سیستم عصبی منجر شود.






